摘 要: 以 ε-己内酯、乙交酯和 DL-丙交酯为单体,丙三醇为起始剂,辛酸亚锡为催化剂,合成了不同分子量的聚酯三元醇。随后将合成的聚酯三元醇引入到聚氨酯体系中,得到聚氨酯骨胶黏剂。利用核磁共振氢谱和红外光谱表征了聚酯三元醇和聚氨酯胶黏剂的结构。利用扫描电子显微镜、万能拉力试验机、差示扫描量热分析仪及恒温震荡箱等仪器研究了不同分子量聚酯三元醇及填料的加入对胶黏剂表面形貌、压缩性能、玻璃化转变温度 (Tg)、黏接强度及降解性能的影响。结果表明:PU-6C400-F 组别显示出了较好的综合性能,黏接强度为 0.93 MPa,压缩强度与模量分别 12.5 MPa 与 128 MPa,该体系有望取代 PMMA 作为骨胶黏剂使用。
粉碎性骨折是生活中常见的损伤之一,较小的碎骨片很难固定,给临床治疗带来了困难。目前主要的治疗方法多是利用螺钉、钢针、钢丝、丝线等进行固定, 或仅保持骨折的力线,但这样往往造成肢体功能障碍等后遗症[1]。而使用骨胶黏剂对碎骨块进行粘合、复位,将小骨块迅速地粘接起来,则是一种更有前景的治疗方法。此外,使用骨胶黏剂可以将应力均匀地负载在骨片上,从而降低应力集中效应,且不需要在愈合完成后移除金属植入物。
理想的骨胶黏剂应满足以下要求:首先,骨胶黏剂必须具有足够的粘合强度,尤其是在潮湿的环境下,因为骨折周围常常有大量的血液和组织液。其次,骨胶黏剂应具有良好的生物相容性,降解产物不含有细胞毒性物质。此外,还需要足够的“工作时间”(即使用胶黏剂将骨片粘接起来所需的操作时间),粘接完成后能快速固化,且反应放热较低[2-3]。
最早作为骨胶黏剂研究的是氰基丙烯酸酯类物质,但其单体的细胞毒性较高,因而并没有相关产品问世。聚甲基丙烯酸甲酯 (PMMA) 骨水泥广泛用于膝关节和髋关节置换中的填充物,但其粘接强度较差,聚合物毒性高,聚合过程中的反应温度较高[4-5]。磷酸钙 (CPC) 骨水泥长期以来被用于骨移植替代品和填充剂,其最显著的优点在于成分与骨骼成分高度相似。但磷酸钙类材料相对脆弱,且对骨的粘附力较差,因此不太适合作为骨胶黏剂使用[2]。将焦磷酸和磷酸丝氨酸掺入 CPC 中,可以提高 CPC 对骨的黏附力[6-7]。生物衍生类胶黏剂,如纤维蛋白胶黏剂[8],贻贝黏附蛋白[9] 和“沙堡胶”[10] 等,通常表现出良好的生物相容性和生物可降解性,但由于其机械性能较低,对骨的附着力较差难以推广应用。
聚氨酯胶黏剂在骨科领域的应用也受到了极大关注。氪石骨水泥 (Kryptonite bone cement,KBC),是一种蓖麻油基聚氨酯胶黏剂,具有良好的机械性能和生物相容性,已被批准用于胸骨闭合的临床实验,但由于其稳定性较好,因此在体内代谢缓慢[11-12]。我们利用 ε-己内酯、乙交酯、DL-丙交酯等进行开环聚合合成聚酯三元醇,并将其引入聚氨酯胶黏剂体系中,获得一种室温固化的聚氨酯胶黏剂,其黏接强度与 KBC 相近[13],且具有较快的降解速率。
1 实验部分
1.1 原料与试剂
五甲基二乙烯三胺、辛酸亚锡:分析纯,上海阿拉丁生化科技有限公司;催化剂 F:分析纯,东曹 (上海) 生物科技有限公司;蓖麻油改性二元醇 (D290):凡特鲁斯 (上海) 贸易有限公司;ε-己内酯、丙三醇:分析纯,阿达玛斯试剂有限公司;乙交酯、DL-丙交酯:分析纯,深圳市博立生物材料有限公司;邻苯二甲酸酐、酚酞、吡啶、氢化钙、无水乙醇、溴甲酚绿、邻苯二甲酸酐、吡啶:分析纯,上海凌峰化学试剂有限公司;二苯基甲烷二异氰酸酯 (MDI-50):纯度,烟台万华股份有限公司;多亚甲基多苯基多异氰酸酯 (PMDI):纯度,巴斯夫股份公司;氘代氯仿 (CDCl3):色谱纯,Sigma-Aldrich 公司;β-磷酸三钙 (β-TCP):纯度,南京埃普瑞纳米材料有限公司;骨水泥 Mendec spine:Tecres 公司。丙三醇使用前 80 ℃ 抽真空除水 3 h。 ε-己内酯加入氢化钙搅拌 24 h 后,减压蒸馏取 110 ℃ 的馏分,密封保存于干燥器中。 D290 使用前 110 ℃ 抽真空除水 2 h。
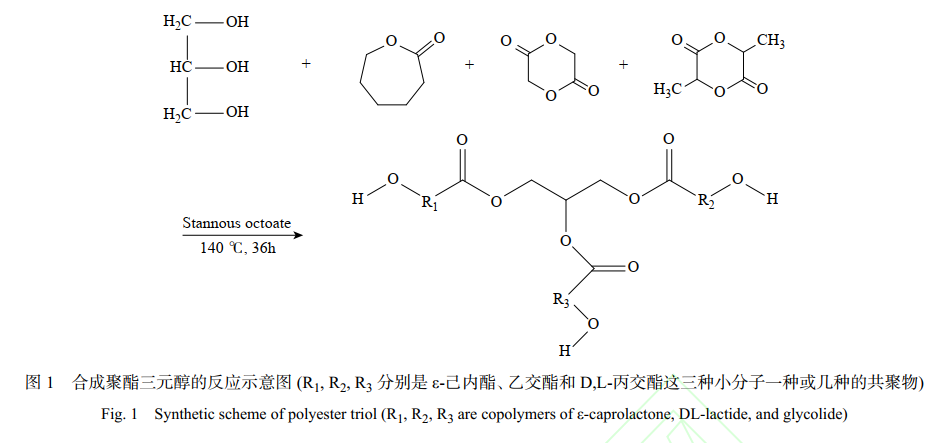
1.2 聚 (ε-己内酯-乙交酯-DL-丙交酯) 三元醇的制备
典型的聚酯三元醇合成反应如下所述[14]。使用注射器,准确移取 11.5 mL 预干燥丙三醇、32.7 mL 预干燥 ε-己内酯于 150 mL 单口烧瓶中,再用分析天平准确称量乙交酯 10.00 g,DL-丙交酯 5.00 g,加入烧瓶中,用移液枪向瓶中加入辛酸亚锡 52 μL (0.1wt%),升温至 140 ℃,在氮气保护下反应 36 h,得到淡黄色液体,并利用羟值滴定法测定所制备的聚酯三元醇分子量。分别制备理论分子量 400 和 800 的聚酯三元醇,并将其依次标记为 6C400 和 6C800。反应中涉及的方程式如图 1 所示:
1.3 羟值滴定
采用苯酐-吡啶滴定法,准确称量 42.00 g 邻苯二甲酸酐溶于 300.0 mL 吡啶中,再加入 6.00 g 咪唑,混合均匀,将酰化剂放置过夜后使用。
准确称取 20.00 g 氢氧化钠,加入 1000 mL 容量瓶中,配置浓度为 0.5 mol/L 的 NaOH 滴定液。用天平称取约 0.4 g/0.8 g(分子量 400/800) 聚酯三元醇 (置于锥形瓶中),用 10 mL 移液管移取预先配制的酰化剂,在115 ℃ 油浴条件下,冷凝回流 0.5 h,使用吡啶多次冲洗冷凝管内壁及塞口上附着的液体至锥形瓶,加 10 mL蒸馏水摇晃数分钟,再加 5 滴提前配置好的质量分数为 1% 的酚酞指示剂,滴定至桃红色,15 s 不褪色,取三次样,滴定三次,取平均值。另做空白实验 (条件相同,不加样品)。并以如下公式计算样品的羟值:
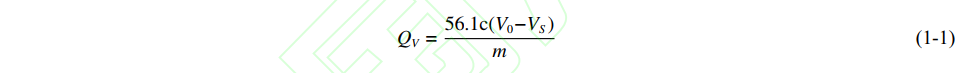
式中 QV 为羟值,c 为 NaOH 滴定液浓度,V0 为空白样滴定体积,VS 为样品滴定体积,m 为所取样品质量。通过羟值滴定计算得到所制备聚酯三元醇 6C400 和 6C800 的分子量分别为 520 和 886。
1.4 蓖麻油基聚氨酯预聚体的合成
按将预先干燥的 D290 (20.0 g) 加入到配备有磁力搅拌器、氮气入口的三颈瓶中,将 MDI-50 (26.9 g)、PMDI (26.9 g) 加入到烧瓶中,在氮气氛下搅拌,并加热至 80 ℃ 反应 2.5 h,得到预聚体。用甲苯-二正丁胺法测定聚氨酯预聚物中 NCO 的含量。
1.5 聚氨酯胶黏剂的合成
将 5.00 g 聚酯三元醇 6C400,0.036 g 催化剂五甲基二乙烯三胺、0.004 g 催化剂 F 与 0.05 g 发泡剂水加入烧杯中,在室温下 1500 r/min 搅拌 2 min,混合均匀后,以异氰酸酯基团与羟基物质的量之比 1∶1 的计量加入10.05 g 预聚体,在 1500 r/min 下搅拌 30 s,转移至模具中,37 ℃ 下固化 24 h,得到聚氨酯 PU-6C400。改变聚酯三元醇类型,用同样方法得到 PU-6C800。对于含有填料的组别,将 β-TCP 先与聚酯三元醇混合后再和预聚体反应,分别得到 PU-6C400-F 和 PU-6C800-F。
1.6 测试与分析
采用德国 AVANCE500 超导傅里叶变换核磁共振波谱仪对聚酯三元醇进行核磁共振氢谱 (1H-NMR) 表征;傅里叶变换红外光谱 (FT-IR) 和全反射红外光谱 (ATR-IR) 均采用美国 Perkin-Elmer 公司 Paragon 1000 傅里叶变换光谱仪器,预聚体样品溶于二氯甲烷中,涂于 KBr 片烘干后测试,聚氨酯样品直接用 ATR-IR 进行测试。参照 GB/T 8813-2008 标准,利用 MTS 公司 Criterion 43 型通用测试仪对聚氨酯样品进行压缩测试;将新鲜猪肋骨抛光为约 8 mm×12 mm×40 mm 的长方体,在中心切成两半,将断裂面粘接,并用磷酸盐缓冲溶液(PBS) 浸湿的纱布包裹,模拟体内环境,在 37 ℃ 的烘箱中固化 24 h,利用 MTS 公司 Criterion 43 型通用测试仪测试胶黏剂的粘接强度;采用 Nova NanoSEM 450 型场发射扫描电子显微镜表征聚氨酯的微观结构;利用美 国 TA 公司 Q2000 型差示扫描量热仪测试样品的玻璃化转变温度;将聚氨酯样品放置于盛有 0.1 mol/L,PH=7.4 PBS 的小瓶中,然后将其置于 37 ℃ 的恒温振荡箱中,测试其降解速率。
2 结果与讨论
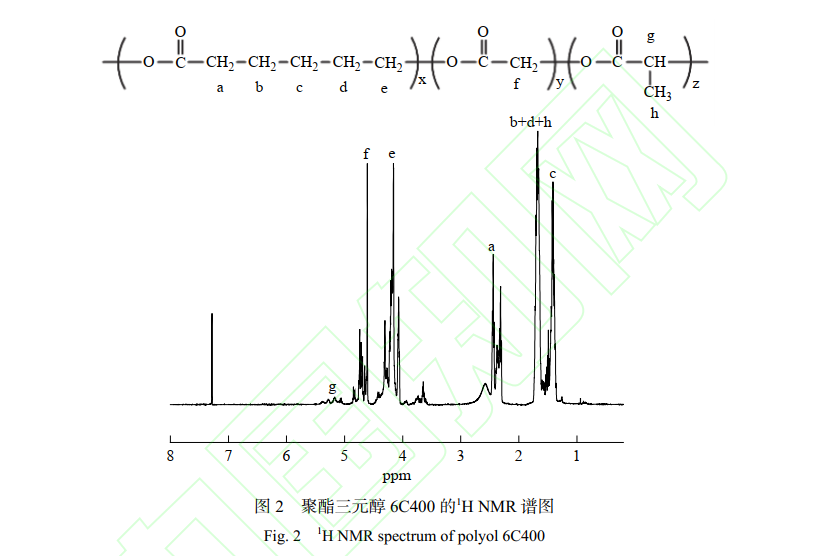
2.1 聚 (ε-己内酯-乙交酯-DL-丙交酯) 三元醇的1H NMR 分析
聚酯三元醇 6C400 的1H-NMR 谱图如图 2 所示。 5.1~5.3 处的吸收峰为 6C400 中丙交酯中次甲基的特征峰;7.2 附近为 CDCl3 峰;4.6~4.9 处的吸收峰为乙交酯中亚甲基的特征吸收峰;4.0~4.2 处和 2.3~2.5 处的特征吸收峰分别为己内酯结构中― OCH2 及― CH2COO 中亚甲基的特征吸收峰。核磁分析表明了成功合成了聚合产物。
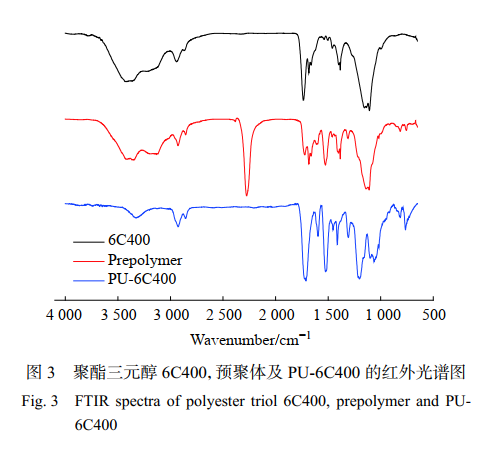
2.2 红外分析
聚酯三元醇 6C400,预聚体及 PU-6C400 的红外光谱如图 3 所示。聚酯三元醇 6C400 的红外光谱图中。 3427 cm-1 处为聚酯三元醇中― OH 的伸缩振动峰,1 734 cm-1 处为 C=O 的伸缩振动峰,1 155 cm-1和 1 107 cm-1 处分别为 C― O 基团的不对称和对称伸缩振动峰。预聚体(prepolymer)的红外光谱图中,2 270 cm-1 处为― NCO 基团的伸缩振动峰 。 PU-6C400 图 中 , 3 340 cm-1 为 ― NH 的 伸 缩 振 动 峰 ,1 530 cm-1 处为― NH 的弯曲振动峰,1 712 cm-1 处为 C=O 的伸缩振动峰,2 930 cm-1,2 854 cm-1 处分别为是― CH2 基团的不对称和对称伸缩振动峰。― NCO 峰的消失以及― NH 峰的出现证明了聚氨酯的成功合成。
2.3 聚氨酯胶黏剂的微观结构分析
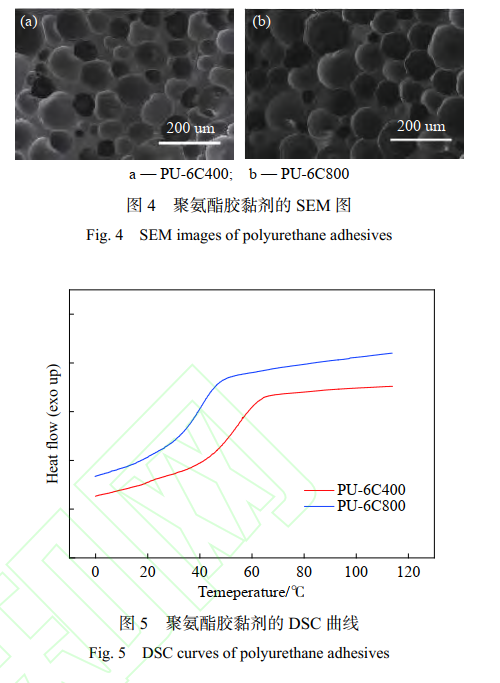
图 4 聚是氨酯胶黏剂的 SEM 图。 PU-6C400 和 PU-6C800 的孔径大小类似,约在 50~150 μm 之间,且孔 壁上有很多破裂的小孔。孔结构对骨组织的形成非常关键,因为它们允许成骨细胞的迁移,浸润和增殖。已有研究表明,骨再生矿化所需孔径的最低要求通常约为 100 μm[15-16]。聚氨酯胶黏剂中孔结构的存在,使其更有利于再生骨的生成。
2.4 聚氨酯胶黏剂的热力学性能
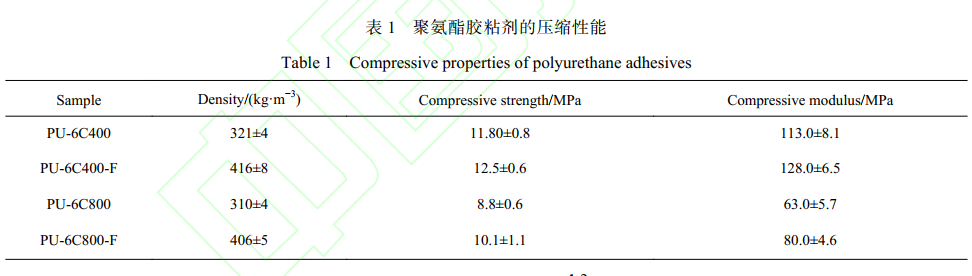
图 5 为聚氨酯胶黏剂的 DSC 曲线。 DSC 曲线中没有熔融峰或者结晶峰出现,说明所合成的聚氨酯为无定形态。 从 DSC 图中可以看出,不同分子量聚酯三元醇合成的聚氨酯胶黏剂的 Tg 有显著差别。 PU-6C400 的 Tg 为 55 ℃,高于 PU-6C800 的 Tg(41 ℃)。这说明利用相对于分子量较大的聚酯三元醇 6C800 制备的 PU-6C800 来说,PU-6C400 分子运动能力较弱,所以在人体内使用时,受到人体温度的影响较小,更适合作为骨胶黏剂使用。
2.5 聚氨酯胶黏剂的压缩性能
聚氨酯胶黏剂的压缩性能如表 1 所示。 PU-6C400 和 PU-6C800 的压缩强度分别为 11.8 MPa 和8.8 MPa,压缩模量分别为 113.0 MPa 和 63.0 MPa。当聚酯三元醇的分子量较大时,其压缩强度和压缩模量降低,这是因为其分子链越长,链段柔顺性越强,强度随之下降。填料对胶黏剂有一定的增强作用,相比于未添加填料的组别,添加 β-TCP 的 PU-6C400-F 和 PU-6C800-F 的模量分别提高了 13% 和 27%。
2.6 聚氨酯胶黏剂的粘接强度
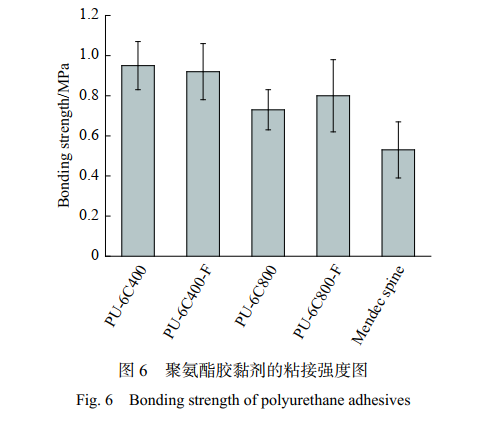
利用对接拉伸模式,测试聚氨酯胶黏剂对骨的黏接强度。从图 6 中可以看出,PU-6C400 和 PU-6C400-F 的 黏 接 强 度 较 高 , 分 别 为 0.95 MPa 与0.92 MPa。 PU-6C800 和 PU-6C800-F 分别为 0.73 MPa和 0.80 MPa。 PU-6C400 和 PU-6C400-F 中聚酯三元醇分子量较小,氨基甲酸酯基团密度较高,故黏接强度较高。对于 PU-6C800 来说其 Tg 较低,在这个温度下其分子链运动能力较强,所以可以在较小的作用力下被破坏,黏接强度较低。 β-TCP 对黏接强度影响较小,这可能是因为聚酯三元醇和预聚体这两种组分相容性较差,混合时黏度较大,填料很难分散。我们还测试了一种基于 PMMA 的商用骨水 泥 Mendec spine,其黏接强度为 0.53 MPa,远低于本实验中所制备的聚氨酯胶黏剂的粘接强度。
2.7 聚氨酯胶黏剂的降解速率
聚氨酯胶黏剂在 PBS 中的体外降解曲线如图 7(a)所示。聚氨酯胶黏剂显示出了较为明显的降解现象。
在 140 d 时,PU-6C400 和 PU-6C800 分别降解了 5.9 % 和 5.0 %。 PU-6C800 的降解速率较快,这可能是因为相同质量下,相比 PU-6C400,其含有的聚酯三元醇组分更多。聚氨酯胶黏剂在 PBS 中降解 140 d 的形貌如图 7(b)和 7(c)所示。孔壁出现了明显的破损现象,这说明含有可降解聚酯三元醇成分的聚氨酯胶黏剂,可以随着材料的降解逐渐提供更多的开孔结构,而这种结构将更有利于细胞的浸润与迁移,从何促进骨生长。

3 结 论
通过开环聚合成功合成两种分子量的聚酯三元醇,并将其引入聚氨酯体系中。聚酯三元醇分子量较小组别的 PU-6C400-F 显示出了较好的综合性能,粘接强度达 0.93 MPa,压缩强度与模量分别 12.5 MPa 与 128 MPa,经 140 d 后的降解量约为 5.0%。
参考文献:
[ 1 ] 肖海军, 薛锋. 医用骨黏合剂的发展及应用进展 [D]., 2011FARRAR D F. Bone adhesives for trauma surgery: A review of challenges and developments [J]. International Journal of Adhesionand Adhesives, 2012, 33: 89-97.
[ 2 ]HEISS C, SCHNETTLER R. Bioresorbable bone adhesives. Historical perspective and current status [J]. Der Unfallchirurg, 2005,108(5): 348-355.
[ 3 ]BRAUER G M, KUMPUL J W, TERMINI D J, et al. Durability of the bond between bone and various 2‐ cyanoacrylates in anaqueous environment [J]. Journal of biomedical materials research, 1979, 13(4): 593-606.
[ 4 ]PAPATHEOFANIS F J. Cytotoxicity of alkyl‐ 2‐ cyanoacrylate adhesives [J]. Journal of biomedical materials research, 1989,23(6): 661-668.
[ 5 ]KIRILLOVA A, KELLY C, VON WINDHEIMN, et al. Bioinspired mineral-organic bioresorbable bone adhesive [J]. AdvancedHealthcare Materials, 2018, 7(17): 1800467.
[ 6 ]GROVER L M, GBURECK U, FARRARD, et al. Adhesion of a novel calcium phosphate cement to cortical bone and severalcommon biomaterials [J]. Key Engineering Materials, 2006, 309-311: 849-852.
[ 7 ]MOBLEY S R, HILINSKI J, TORIUMI D M. Surgical tissue adhesives [J]. Facial Plastic Surgery Clinics of North America,2002, 10(2): 147-154.
[ 8 ]LU D, WANG H, Li T, et al. Mussel-inspired thermoresponsive polypeptide-pluronic copolymers for versatile surgical adhesives andhemostasis [J]. ACS Applied Materials & Interfaces, 2017, 9(20): 16756-16766.
[ 9 ]SHAO H, BACHUS K N, STEWART R J. A water‐ borne adhesive modeled after the sandcastle glue of P. californica [J].Macromolecular Bioscience, 2009, 9(5): 464-471.
[10]
[11] FEDAK P W M, KASATKIN A. Enhancing sternal closure using Kryptonite bone adhesive: Technical report [J]. Surgical innovation, 2011, 18(4): NP8-NP11.FEDAK P W M, KIESER T M, MAITLAND A M, et al. Adhesive-enhanced sternal closure to improve postoperative functionalrecovery: a pilot, randomized controlled trial [J]. The Annals of thoracic surgery, 2011, 92(4): 1444-1450.
[12]BOXBERGERJ I, ADAMS D J, DIAZ-DORAN V, et al. Radius fracture repair using volumetrically expanding polyurethane bonecement [J]. The Journal of hand surgery, 2011, 36(8): 1294-1302.
[13]HAFEMAN A E, ZIENKIEWICZ K J, ZACHMAN A L, et al. Characterization of the degradation mechanisms of lysine-derivedaliphatic poly (ester urethane) scaffolds [J]. Biomaterials, 2011, 32(2): 419-429.
[14]HULBERT S F, YOUNG F A, MATHEWS R S, et al. Potential of ceramic materials as permanently implantable skeletal prostheses[J]. Journal of biomedical materials research, 1970, 4(3): 433-456.
[15]KARAGEORGIOU V, KAPLAN D. Porosity of 3D biomaterial scaffolds and osteogenesis [J]. Biomaterials, 2005, 26(27):5474-5491.
欢迎来电垂询消防水带、自救卷盘、聚氨酯水带、双面胶水带、船用水带、森林水带、橡塑水带、pvc水带、水幕水带等相关产品信息:18936241119。







管理员
该内容暂无评论